- Предсказание критического состояния газов кто открыл
- Критическая температура
- Учебники
- Журнал «Квант»
- Общие
- Критическое состояние вещества
- Литература
- Критическая точка (термодинамика) — Critical point (thermodynamics)
- СОДЕРЖАНИЕ
- Критическая точка жидкость – пар
- Обзор
- История
- Теория
- Таблица критических температуры и давления жидкости и пара для выбранных веществ
- Смеси: жидкость – критическая точка жидкости
- Математическое определение
Предсказание критического состояния газов кто открыл
Критическая температура
Как превратить газ в жидкость? График кипения отвечает на этот вопрос. Превратить газ в жидкость можно, либо уменьшая температуру, либо увеличивая давление.
В XIX веке повышение давления представлялось задачей более легкой, чем понижение температуры. В начале этого столетия великому английскому физику Михаилу Фараде удалось сжать газы до значений упругости паров и таким способом превратить в жидкость много газов (хлор, углекислый газ и др.).
Однако некоторые газы — водород, азот, кислород — никак не поддавались сжижению. Сколько ни увеличивали давление, они не превращались в жидкость. Можно было подумать, что кислород и другие газы не могут быть жидкими. Их причислили к истинным, или постоянным, газам.
На самом же деле неудачи были вызваны непониманием одного важного обстоятельства.
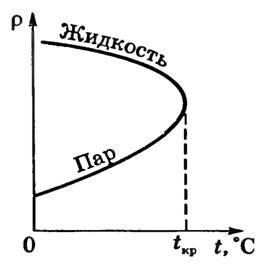
Рассмотрим жидкость и пар, находящиеся в равновесии, и подумаем, что происходит с ними при возрастании температуры кипения и, разумеется, соответствующем возрастании давления. Иначе говоря, представим себе, что точка на графике кипения движется вдоль кривой вверх. Ясно, что жидкость при повышении температуры расширяется и плотность ее падает. Что же касается пара, то увеличение температуры кипения? разумеется, способствует его расширению, но, как мы уже говорили, давление насыщенного пара растет значительно быстрее, чем температура кипения. Поэтому плотность пара не падает, а, наоборот, быстро растет с увеличением температуры кипения.
Поскольку плотность жидкости падает, а плотность пара растет, то, двигаясь «вверх» по кривой кипения, мы неминуемо доберемся до такой точки, в которой плотности жидкости и пара сравняются (рис. 4.3).
В этой замечательной точке,- которая называется критической, кривая кипения обрывается. Так как все различия между газом и жидкостью связаны с разницей в плотности, то в критической точке свойства жидкости и газа становятся одинаковыми. Для каждого вещества существует своя критическая температура и свое критическое давление. Так, для воды критическая точка соответствует температуре 374°С и давлению 218,5 атм.
Если сжимать газ, температура которого ниже критической, то процесс его сжатия изобразится стрелкой, пересекающей кривую кипения (рис. 4.4). Это значит, что в момент достижения давления, равного упругости пара (точка пересечения стрелки с кривой кипения), газ начнет конденсироваться в жидкость. Если бы наш сосуд был прозрачным, то в этот момент мы увидели бы начало образования слоя жидкости на дне сосуда. При неизменном давлении слой жидкости будет расти, пока, наконец, весь газ не превратится в жидкость. Дальнейшее сжатие потребует уже увеличения давления.
Совершенно иначе обстоит дело при сжатии газа, температура которого выше критической. Процесс сжатия опять-таки можно изобразить в виде стрелки, идущей снизу вверх. Но теперь эта стрелка не пересекает кривую кипения. Значит, при сжатии пар не будет конденсироваться, а будет лишь непрерывно уплотняться.
При температуре выше критической невозможно существование жидкости и газа, поделенных границей раздела: При сжатии до любых плотностей под поршнем будет находиться однородное вещество, и трудно сказать, когда его можно назвать газом, а когда — жидкостью.
Наличие критической точки показывает, что между жидким и газообразным состоянием нет принципиального различия. На первый взгляд могло бы показаться, что такого принципиального различия нет только в том случае, когда речь идет о температурах выше критической. Это, однако, не так. Существование- критической точки указывает на возможность превращения жидкости — самой настоящей жидкости, которую можно налить в стакан — в газообразное состояние без всякого подобия кипения.
Такой путь превращения показан на рис. 4.4. Крестиком отмечена заведомая жидкость. Если немного понизить давление (стрелка вниз), она закипит, закипит она и в том случае, если немного повысить температуру (стрелка вправо). Но мы поступим совсем иначе, Сожмем жидкость весьма сильно, до давления выше критического. Точка, изображающая состояние жидкости, пойдет вертикально вверх. Затем подогреем жидкость — этот процесс изобразится горизонтальной линией. Теперь, после того как мы очутились правее Критической температуры, понизим давление до исходного. Если теперь уменьшить температуру, то можно получить самый настоящий пар, который мог быть получен из этой жидкости более простым и коротким путем.
Таким образом, всегда возможно, изменяя давление и температуру в обход критической точки, получить пар путем непрерывного перехода его из жидкости или жидкость из пара. Такой непрерывный переход не требует кипения или конденсации.
Ранние попытки сжижения таких газов, как кислород, азот, водород, потому и были неудачны, что не было известно о существовании критической температуры. У этих газов критические температуры очень низкие: у азота -147°С, у кислорода -119°С, у водорода -240°С, или 33 К. Рекордсменом является гелий, его критическая температура равна 4,3 К. Превратить эти газы в жидкость можно лишь одним’ способом — надо снизить их температуру ниже указанной»
Источник
Учебники
Журнал «Квант»
Общие
Критическое состояние вещества
Сходство свойств ненасыщенных паров и газов натолкнуло М. Фарадея на предположение: не являются ли газы ненасыщенными парами соответствующих жидкостей? Если предположение верно, то можно попытаться сделать их насыщенными и сконденсировать. Действительно, сжатием удалось сделать насыщенными многие газы, кроме шести, которые М. Фарадей назвал «постоянными»: это азот, водород, воздух, гелий, кислород, оксид углерода CO.
Чтобы понять, в чем здесь дело, изучим подробнее изотермический процесс сжатия (расширения) пара. Мы видели, что изотерма реального газа отличается от изотермы идеального газа наличием горизонтального участка, соответствующего области существования двухфазной системы: насыщенного пара и жидкости.
Если проводить опыты при более высоких температурах (T1 Рис. 1
Во-первых, чем выше температура, тем меньше объем, при котором начинается конденсация газа: V1 > V’1 > V’’1, если T1 V2
Следовательно, длина прямолинейного участка изотермы с ростом температуры уменьшается.
Это легко объяснить: с ростом Τ давление насыщенного пара быстро нарастает, и для того, чтобы давление ненасыщенного пара сравнялось с давлением насыщенного, необходимо уменьшение объема. Причина увеличения объема V2 — в тепловом расширении жидкости при нагревании. Так как объем V1 уменьшается, то плотность паров при увеличении температуры увеличивается; увеличение объема V2 свидетельствует об уменьшении плотности жидкости. Это значит, что различие между жидкостью и ее насыщенным паром в процессе такого нагревания сглаживается и при достаточно высокой температуре должно исчезнуть совсем.
Д. Менделеев установил, что для каждой жидкости должна существовать такая температура, которая экспериментально впервые была установлена для многих веществ Т. Эндрюсом и носит название критической температуры.
Критическая температура Tкр — это такая температура, при которой плотность жидкости и плотность ее насыщенного пара становятся одинаковыми (рис. 2).
На изотермах при Т = Tкр горизонтальный участок превращается в точку перегиба К.
Давление насыщенного пара какого-либо вещества при его критической температуре называется критическим давлением pкр. Оно является наибольшим возможным давлением насыщенных паров вещества.
Объем, который занимает вещество при pкр и tкр, называется критическим объемом Vкр. Это наибольший объем, который может занимать имеющаяся масса вещества в жидком состоянии.
При критической температуре различие между газом и жидкостью исчезает, и поэтому удельная теплота парообразования становится равной нулю.
Совокупность точек, соответствующих краям горизонтального участка изотерм (см. рис. 1), выделяет в плоскости p-V области существования двухфазной системы и отделяет ее от областей однофазных состояний вещества. Пограничная кривая области двухфазных состояний со стороны больших значений объема описывает состояние насыщенного пара и одновременно представляет собой кривую конденсации (начинается конденсация пара при изотермическом сжатии). Пограничная кривая со стороны меньших объемов представляет собой кривую, на которой заканчивается конденсация при сжатии насыщенного пара и начинается испарение жидкости при изотермическом расширении. Ее называют кривой испарения.
Существование критической температуры вещества объясняет, почему при обычных температурах одни вещества могут быть как жидкими, так и газообразными, а другие остаются газами.
Выше критической температуры жидкость не образуется даже при очень высоких давлениях.
Причина заключается в том, что здесь интенсивность теплового движения молекул оказывается настолько большой, что даже при относительно плотной их упаковке, вызванной большим давлением, молекулярные силы не могут обеспечить создание даже ближнего, а тем более дальнего порядка.
Таким образом, видно, что принципиальной разницы между газом и паром нет. Обычно газом называют вещество в газообразном состоянии, когда его температура выше критической. Паром называют также вещество в газообразном состоянии, но когда его температура ниже критической. Пар можно перевести в жидкость одним только увеличением давления, а газ нельзя.
В настоящее время все газы переведены в жидкое состояние при очень низких температурах. Последним в 1908 г. переведен гелий (tкр = -269 °С).
Литература
Аксенович Л. А. Физика в средней школе: Теория. Задания. Тесты: Учеб. пособие для учреждений, обеспечивающих получение общ. сред, образования / Л. А. Аксенович, Н.Н.Ракина, К. С. Фарино; Под ред. К. С. Фарино. — Мн.: Адукацыя i выхаванне, 2004. — C. 176-178.
Источник
Критическая точка (термодинамика) — Critical point (thermodynamics)
- Субкритический этан , жидкая и газовая фазы сосуществуют.
- Критическая точка (32,17 ° C, 48,72 бар), опалесценция.
- Сверхкритический этан , жидкость .
В термодинамике , А критическая точка (или критическое состояние ) является конечной точкой фазового равновесия кривой. Наиболее ярким примером является критическая точка жидкость – пар, конечная точка кривой давление – температура, которая обозначает условия, при которых жидкость и ее пар могут сосуществовать. При более высоких температурах газ нельзя сжижать только под давлением. В критической точке, определяемой критической температурой T c и критическим давлением p c , фазовые границы исчезают. Другие примеры включают критические точки жидкость – жидкость в смесях.
СОДЕРЖАНИЕ
Критическая точка жидкость – пар
Обзор
Для простоты и ясности общее понятие критической точки лучше всего вводить, обсуждая конкретный пример — критическую точку жидкость – пар. Это была первая открытая критическая точка, и она до сих пор остается самой известной и наиболее изученной.
Рисунке справа показана схема СТ — схема , из чистого вещества (в отличие от смесей, которые имеют дополнительные переменные состояния и богаче фазовые диаграммы, обсуждаемые ниже). Общеизвестные фазы — твердое тело , жидкость и пар — разделены фазовыми границами, то есть комбинациями давления и температуры, при которых две фазы могут сосуществовать. В тройной точке все три фазы могут сосуществовать. Однако граница жидкость – пар заканчивается в конечной точке при некоторой критической температуре T c и критическом давлении p c . Это критический момент .
В воде критическая точка находится при 647,096 К (373,946 ° C; 705,103 ° F) и 22,064 мегапаскалей (3200,1 фунт / кв. Дюйм; 217,75 атм).
В окрестностях критической точки, физические свойства жидкости и резко изменить пара, с обеими фазами становятся все более похожими. Например, жидкая вода при нормальных условиях почти несжимаема, имеет низкий коэффициент теплового расширения, высокую диэлектрическую проницаемость и является отличным растворителем для электролитов. Вблизи критической точки все эти свойства меняются прямо противоположными: вода становится сжимаемой, расширяемой, имеет плохой диэлектрик , плохой растворитель для электролитов и предпочитает смешиваться с неполярными газами и органическими молекулами.
В критической точке существует только одна фаза. Теплота парообразования равна нулю. На фотоэлектрической диаграмме есть стационарная точка перегиба на линии постоянной температуры ( критическая изотерма ) . Это означает, что в критической точке:
( ∂ п ∂ V ) Т знак равно 0 , <\ displaystyle \ left (<\ frac <\ partial p><\ partial V>> \ right) _ 
Выше критической точки существует состояние вещества, которое непрерывно связано (может быть преобразовано без фазового перехода) как в жидкое, так и в газообразное состояние. Это называется сверхкритической жидкостью . Распространенное в учебниках знание о том, что все различия между жидкостью и паром исчезают за пределами критической точки, было оспорено Фишером и Уидомом , которые идентифицировали линию p — T , разделяющую состояния с различными асимптотическими статистическими свойствами ( линия Фишера – Уидома ).
Иногда критическая точка не проявляется в большинстве термодинамических или механических свойств, но она «скрыта» и проявляется в возникновении неоднородностей в модулях упругости, заметных изменениях внешнего вида и локальных свойств неаффинных капель и внезапном усилении концентрация пар дефектов.
История
Существование критической точки было впервые обнаружено Шарлем Каньяром де ла Тур в 1822 году и названо Дмитрием Менделеевым в 1860 году и Томасом Эндрюсом в 1869 году. Каньяр показал, что CO 2 может сжижаться при 31 ° C и давлении 73 атм, но не при чуть более высокой температуре, даже при давлении до 3000 атм.
Теория
Решая указанное выше условие для уравнения Ван-дер-Ваальса , можно вычислить критическую точку как ( ∂ п / ∂ V ) Т знак равно 0 <\ Displaystyle (\ partial p / \ partial V) _
Т c знак равно 8 а 27 р б , V c знак равно 3 п б , п c знак равно а 27 б 2 . <\ displaystyle T _ <\ text
Однако уравнение Ван-дер-Ваальса, основанное на теории среднего поля , не выполняется вблизи критической точки. В частности, он предсказывает неправильные законы масштабирования .
Чтобы проанализировать свойства жидкостей вблизи критической точки, приведенные переменные состояния иногда определяют относительно критических свойств.
Т р знак равно Т Т c , п р знак равно п п c , V р знак равно V р Т c / п c . <\ displaystyle T _ <\ text Принцип соответственных состояний указует на то, что вещества при равном пониженном давлении и температуре , имеют равные объемы уменьшенные. Это соотношение приблизительно верно для многих веществ, но становится все более неточным при больших значениях p r . Для некоторых газов существует дополнительный поправочный коэффициент, называемый поправкой Ньютона , который добавляется к критической температуре и критическому давлению, рассчитанным таким образом. Это значения, полученные эмпирическим путем, которые меняются в зависимости от интересующего диапазона давления. Жидкость-жидкость критическая точка раствора, которое происходит при критической температуре раствора , происходит на границе двухфазной области фазовой диаграммы. Другими словами, это точка, в которой бесконечно малое изменение какой-либо термодинамической переменной (например, температуры или давления) приводит к разделению смеси на две отдельные жидкие фазы, как показано на диаграмме состояния полимер-растворитель справа. Два типа критических точек жидкость-жидкость: верхняя критическая температура раствора (UCST), которая является самой горячей точкой, при которой охлаждение вызывает разделение фаз, и нижняя критическая температура раствора (LCST), которая является самой холодной точкой, при которой нагрев вызывает фазу. разделение. С теоретической точки зрения критическая точка жидкость – жидкость представляет собой температурно – концентрационный экстремум спинодали (как видно на рисунке справа). Таким образом, критическая точка жидкость – жидкость в двухкомпонентной системе должна удовлетворять двум условиям: условию спинодали ( вторая производная свободной энергии по концентрации должна равняться нулю) и условию экстремума ( третья производная свободной энергии по концентрации также должна равняться нулю или производная температуры спинодали по концентрации должна равняться нулю). ИсточникТаблица критических температуры и давления жидкости и пара для выбранных веществ
Вещество Критическая температура Критическое давление (абсолютное) Аргон -122,4 ° С (150,8 К) 48,1 атм (4870 кПа) Аммиак (NH 3 ) 132,4 ° С (405,5 К) 111,3 атм (11280 кПа) R-134a 101,06 ° С (374,21 К) 40,06 атм (4059 кПа) R-410A 72,8 ° С (345,9 К) 47,08 атм (4770 кПа) Бром 310,8 ° С (584,0 К) 102 атм (10300 кПа) Цезий 1664,85 ° С (1938,00 К) 94 атм (9500 кПа) Хлор 143,8 ° С (416,9 К) 76,0 атм (7700 кПа) Этанол (C 2 H 5 OH) 241 ° С (514 К) 62,18 атм (6300 кПа) Фтор -128,85 ° С (144,30 К) 51,5 атм (5220 кПа) Гелий -267,96 ° С (5,19 К) 2,24 атм (227 кПа) Водород -239,95 ° С (33,20 К) 12,8 атм (1300 кПа) Криптон -63,8 ° С (209,3 К) 54,3 атм (5500 кПа) Метан (CH 4 ) -82,3 ° С (190,8 К) 45,79 атм (4640 кПа) Неон -228,75 ° С (44,40 К) 27,2 атм (2760 кПа) Азот -146,9 ° С (126,2 К) 33,5 атм (3390 кПа) Кислород (O 2 ) -118,6 ° С (154,6 К) 49,8 атм (5050 кПа) Углекислый газ (CO 2 ) 31,04 ° С (304,19 К) 72,8 атм (7380 кПа) Закись азота (N 2 O) 36,4 ° С (309,5 К) 71,5 атм (7240 кПа) Серная кислота (H 2 SO 4 ) 654 ° С (927 К) 45,4 атм (4600 кПа) Ксенон 16,6 ° С (289,8 К) 57,6 атм (5840 кПа) Литий 2950 ° С (3220 К) 652 атм (66100 кПа) Меркурий 1476,9 ° С (1750,1 К) 1720 атм (174000 кПа) Сера 1040,85 ° С (1314,00 К) 207 атм (21000 кПа) Утюг 8227 ° С (8500 К) Золото 6977 ° С (7250 К) 5000 атм (510 000 кПа) Алюминий 7 577 ° С (7850 К) Вода (H 2 O) 373,946 ° С (647,096 К) 217,7 атм (22060 кПа) Смеси: жидкость – критическая точка жидкости
Математическое определение