- Кому принадлежит предсказание критического состояния газов
- Критическая температура
- Учебники
- Журнал «Квант»
- Общие
- Критическое состояние вещества
- Литература
- Реальные газы. Критическое состояние. Изотерма реального газа. Сжигание газов. Их применение.
- Физика Б1.Б8.
- Молекулярная физика и термодинамика
- 1. Введение
Кому принадлежит предсказание критического состояния газов
Критическая температура
Как превратить газ в жидкость? График кипения отвечает на этот вопрос. Превратить газ в жидкость можно, либо уменьшая температуру, либо увеличивая давление.
В XIX веке повышение давления представлялось задачей более легкой, чем понижение температуры. В начале этого столетия великому английскому физику Михаилу Фараде удалось сжать газы до значений упругости паров и таким способом превратить в жидкость много газов (хлор, углекислый газ и др.).
Однако некоторые газы — водород, азот, кислород — никак не поддавались сжижению. Сколько ни увеличивали давление, они не превращались в жидкость. Можно было подумать, что кислород и другие газы не могут быть жидкими. Их причислили к истинным, или постоянным, газам.
На самом же деле неудачи были вызваны непониманием одного важного обстоятельства.
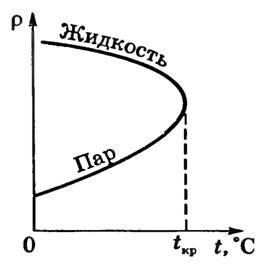
Рассмотрим жидкость и пар, находящиеся в равновесии, и подумаем, что происходит с ними при возрастании температуры кипения и, разумеется, соответствующем возрастании давления. Иначе говоря, представим себе, что точка на графике кипения движется вдоль кривой вверх. Ясно, что жидкость при повышении температуры расширяется и плотность ее падает. Что же касается пара, то увеличение температуры кипения? разумеется, способствует его расширению, но, как мы уже говорили, давление насыщенного пара растет значительно быстрее, чем температура кипения. Поэтому плотность пара не падает, а, наоборот, быстро растет с увеличением температуры кипения.
Поскольку плотность жидкости падает, а плотность пара растет, то, двигаясь «вверх» по кривой кипения, мы неминуемо доберемся до такой точки, в которой плотности жидкости и пара сравняются (рис. 4.3).
В этой замечательной точке,- которая называется критической, кривая кипения обрывается. Так как все различия между газом и жидкостью связаны с разницей в плотности, то в критической точке свойства жидкости и газа становятся одинаковыми. Для каждого вещества существует своя критическая температура и свое критическое давление. Так, для воды критическая точка соответствует температуре 374°С и давлению 218,5 атм.
Если сжимать газ, температура которого ниже критической, то процесс его сжатия изобразится стрелкой, пересекающей кривую кипения (рис. 4.4). Это значит, что в момент достижения давления, равного упругости пара (точка пересечения стрелки с кривой кипения), газ начнет конденсироваться в жидкость. Если бы наш сосуд был прозрачным, то в этот момент мы увидели бы начало образования слоя жидкости на дне сосуда. При неизменном давлении слой жидкости будет расти, пока, наконец, весь газ не превратится в жидкость. Дальнейшее сжатие потребует уже увеличения давления.
Совершенно иначе обстоит дело при сжатии газа, температура которого выше критической. Процесс сжатия опять-таки можно изобразить в виде стрелки, идущей снизу вверх. Но теперь эта стрелка не пересекает кривую кипения. Значит, при сжатии пар не будет конденсироваться, а будет лишь непрерывно уплотняться.
При температуре выше критической невозможно существование жидкости и газа, поделенных границей раздела: При сжатии до любых плотностей под поршнем будет находиться однородное вещество, и трудно сказать, когда его можно назвать газом, а когда — жидкостью.
Наличие критической точки показывает, что между жидким и газообразным состоянием нет принципиального различия. На первый взгляд могло бы показаться, что такого принципиального различия нет только в том случае, когда речь идет о температурах выше критической. Это, однако, не так. Существование- критической точки указывает на возможность превращения жидкости — самой настоящей жидкости, которую можно налить в стакан — в газообразное состояние без всякого подобия кипения.
Такой путь превращения показан на рис. 4.4. Крестиком отмечена заведомая жидкость. Если немного понизить давление (стрелка вниз), она закипит, закипит она и в том случае, если немного повысить температуру (стрелка вправо). Но мы поступим совсем иначе, Сожмем жидкость весьма сильно, до давления выше критического. Точка, изображающая состояние жидкости, пойдет вертикально вверх. Затем подогреем жидкость — этот процесс изобразится горизонтальной линией. Теперь, после того как мы очутились правее Критической температуры, понизим давление до исходного. Если теперь уменьшить температуру, то можно получить самый настоящий пар, который мог быть получен из этой жидкости более простым и коротким путем.
Таким образом, всегда возможно, изменяя давление и температуру в обход критической точки, получить пар путем непрерывного перехода его из жидкости или жидкость из пара. Такой непрерывный переход не требует кипения или конденсации.
Ранние попытки сжижения таких газов, как кислород, азот, водород, потому и были неудачны, что не было известно о существовании критической температуры. У этих газов критические температуры очень низкие: у азота -147°С, у кислорода -119°С, у водорода -240°С, или 33 К. Рекордсменом является гелий, его критическая температура равна 4,3 К. Превратить эти газы в жидкость можно лишь одним’ способом — надо снизить их температуру ниже указанной»
Источник
Учебники
Журнал «Квант»
Общие
Критическое состояние вещества
Сходство свойств ненасыщенных паров и газов натолкнуло М. Фарадея на предположение: не являются ли газы ненасыщенными парами соответствующих жидкостей? Если предположение верно, то можно попытаться сделать их насыщенными и сконденсировать. Действительно, сжатием удалось сделать насыщенными многие газы, кроме шести, которые М. Фарадей назвал «постоянными»: это азот, водород, воздух, гелий, кислород, оксид углерода CO.
Чтобы понять, в чем здесь дело, изучим подробнее изотермический процесс сжатия (расширения) пара. Мы видели, что изотерма реального газа отличается от изотермы идеального газа наличием горизонтального участка, соответствующего области существования двухфазной системы: насыщенного пара и жидкости.
Если проводить опыты при более высоких температурах (T1 Рис. 1
Во-первых, чем выше температура, тем меньше объем, при котором начинается конденсация газа: V1 > V’1 > V’’1, если T1 V2
Следовательно, длина прямолинейного участка изотермы с ростом температуры уменьшается.
Это легко объяснить: с ростом Τ давление насыщенного пара быстро нарастает, и для того, чтобы давление ненасыщенного пара сравнялось с давлением насыщенного, необходимо уменьшение объема. Причина увеличения объема V2 — в тепловом расширении жидкости при нагревании. Так как объем V1 уменьшается, то плотность паров при увеличении температуры увеличивается; увеличение объема V2 свидетельствует об уменьшении плотности жидкости. Это значит, что различие между жидкостью и ее насыщенным паром в процессе такого нагревания сглаживается и при достаточно высокой температуре должно исчезнуть совсем.
Д. Менделеев установил, что для каждой жидкости должна существовать такая температура, которая экспериментально впервые была установлена для многих веществ Т. Эндрюсом и носит название критической температуры.
Критическая температура Tкр — это такая температура, при которой плотность жидкости и плотность ее насыщенного пара становятся одинаковыми (рис. 2).
На изотермах при Т = Tкр горизонтальный участок превращается в точку перегиба К.
Давление насыщенного пара какого-либо вещества при его критической температуре называется критическим давлением pкр. Оно является наибольшим возможным давлением насыщенных паров вещества.
Объем, который занимает вещество при pкр и tкр, называется критическим объемом Vкр. Это наибольший объем, который может занимать имеющаяся масса вещества в жидком состоянии.
При критической температуре различие между газом и жидкостью исчезает, и поэтому удельная теплота парообразования становится равной нулю.
Совокупность точек, соответствующих краям горизонтального участка изотерм (см. рис. 1), выделяет в плоскости p-V области существования двухфазной системы и отделяет ее от областей однофазных состояний вещества. Пограничная кривая области двухфазных состояний со стороны больших значений объема описывает состояние насыщенного пара и одновременно представляет собой кривую конденсации (начинается конденсация пара при изотермическом сжатии). Пограничная кривая со стороны меньших объемов представляет собой кривую, на которой заканчивается конденсация при сжатии насыщенного пара и начинается испарение жидкости при изотермическом расширении. Ее называют кривой испарения.
Существование критической температуры вещества объясняет, почему при обычных температурах одни вещества могут быть как жидкими, так и газообразными, а другие остаются газами.
Выше критической температуры жидкость не образуется даже при очень высоких давлениях.
Причина заключается в том, что здесь интенсивность теплового движения молекул оказывается настолько большой, что даже при относительно плотной их упаковке, вызванной большим давлением, молекулярные силы не могут обеспечить создание даже ближнего, а тем более дальнего порядка.
Таким образом, видно, что принципиальной разницы между газом и паром нет. Обычно газом называют вещество в газообразном состоянии, когда его температура выше критической. Паром называют также вещество в газообразном состоянии, но когда его температура ниже критической. Пар можно перевести в жидкость одним только увеличением давления, а газ нельзя.
В настоящее время все газы переведены в жидкое состояние при очень низких температурах. Последним в 1908 г. переведен гелий (tкр = -269 °С).
Литература
Аксенович Л. А. Физика в средней школе: Теория. Задания. Тесты: Учеб. пособие для учреждений, обеспечивающих получение общ. сред, образования / Л. А. Аксенович, Н.Н.Ракина, К. С. Фарино; Под ред. К. С. Фарино. — Мн.: Адукацыя i выхаванне, 2004. — C. 176-178.
Источник
Реальные газы. Критическое состояние. Изотерма реального газа. Сжигание газов. Их применение.



Для реальных газов, то есть для газов, существующих в природе и находящихся в условиях сравнительно высокого давления и низких температур, необходимо учитывать силы межмолекулярного притяжения (силы Ван-дер-Ваальса) и объём самих молекул газа. Реальные газы в условиях, близких к идеальным, должны в большей мере подчиняться законам идеальных газов. Наоборот, чем больше отличаются эти условия от идеальных, тем больше отклонения от законов идеальных газов. При высоком давлении и низкой температуре расстояния между молекулами уменьшаются, а силы межмолекулярных взаимодействий увеличиваются настолько, что вещество из газообразного состояния может перейти в жидкое состояние. Этим пользуются для получения сжиженных газов. Необходимые для этого низкие температуры получают за счёт расширения предварительного сжатого компрессором газа: при последующем расширении газа на преодоление сил межмолекулярного взаимодействия затрачивается Етяж, которую газ забирает из окружающей среды, из-за чего она охлаждается. Многократно повторяя сжатие и сжатие и расширение газа, можно получить достаточно низкую температуру для охлаждения сжимаемого газа
В 1860 г. Д.И. Менделеев создал теорию сжигания газов.
Для каждого газа существует предельная температура, выше которой газ не может быть превращён в жидкость ни при каком давлении (критическая). При критической температуре для снижения необходимого наибольшее критическое давление.
Объём 1 моля газа при критическом давлении и критической температуре называется критическим объёмом.
Состояние газа, находящегося под критическим давлением и критической температурой и занимающего критический объём, называется критическим состоянием.

Р= 72,9 атм критическое состояние
Если например, температура больше критической, то СО2 ни при каком давлении не перейдёт в жидкость.
Кривые зависимости давления от объёма при T=const называются изотермами:
Для 10 о С : АВ, ВС, СD
АВ – газ подчиняется закону Бойля-Мариотта – объем уменьшается прямо пропорционально давлению
ВС – объем резко уменьшается при P=const, что характерно для перехода газа в жидком состоянии.
СD – не наблюдается заметного уменьшения объема, с увеличением давления газ не сжимается, несмотря на зна-
чительное увеличение давления. Это харак-
терно для жидкого состояния.
При более высоких температурах горизонтальные участки изотерм, соответствующие ВС, постепенно уменьшаются и при 31,0 о С превращаются в точку перегиба К. Исчезновение горизонтального ВС на изотерме объясняется тем, что для данного вещества на изотерме объясняется тем, что для данного вещества существует некоторая t, выше которой газ ни при каких условиях не превращается в жидкость. Точка К, отвечающая такому состоянию, называетсякритической.
При увеличении температуры дальше изотермы всё более приближаются к изотермам идеального газа.
Жидкие газы применяются для получения низких температур в технике и лабораториях, удобна транспортировка. В общественном питании для приготовления шипучих напитков используется диоксид углерода, поставляемый в баллонах в сжиженном состоянии. Жидкая углекислота используется также для тушения пожаров. Для замораживания пищевых продуктов стал применяться жидкий азот, при температуре меньше – 73 о С – криогенное замораживание. Криогенному замораживанию можно подвергать грибы, хлебобулочные изделия, морские продукты и другое.
Источник
Физика Б1.Б8.
Молекулярная физика и термодинамика
1. Введение
Молекулярная физика — это раздел физики, который рассматривает свойства макроскопических тел и их агрегатные состояния с точки зрения их молекулярного строения, взаимодействия и движения молекул. Она изучает явления, происходящие внутри макроскопических тел.
Основы молекулярной физики были заложены трудами Ломоносова, Джоуля, Больцмана, Клаузиуса, Максвелла и других ученых. Благодаря их трудам молекулярная физика прочно утвердилась в науке. Непосредственным опытным подтверждением молекулярно-кинетической теории являются процесс диффузии, броуновского движения, распространения запаха и многие другие явления.
Движение каждой молекулы в веществе может быть описано законами классической механики. Однако число молекул в веществе чрезвычайно велико, направления и величины скоростей молекул совершенно случайны и непрерывно изменяются так, что становится невозможным охватить уравнениями движения всю совокупность молекул и сделать какие-либо выводы об их поведении.
Тем не менее, состояние вещества и его изменение определяется заданием небольшого числа определенных параметров, как температура, давление, объем, плотность и т.д., значения которых невозможно указать на основе решений уравнений классической механики. Дело в том, что свойства огромного числа молекул подчиняется особым, статистическим закономерностям. Статистическая физика изучает статистические закономерности, описывающие поведение большой совокупности объектов. Она основывается на теории вероятностей и позволяет вычислять средние значения величин, характеризующих движение всей совокупности молекул (средние скорости молекул, средние кинетические энергии, средние значения импульса и т. д.) и на этой основе истолковывает свойства вещества, непосредственно наблюдаемые на опыте (давление, температура и т.д.). В этом состоит суть молекулярно-кинетического изучения вещества.
Наряду со статистическим, существует термодинамический метод изучения вещества. В отличие от статистического метода термодинамический метод не интересуется строением вещества. Термодинамика изучают условия превращения энергии и характеризует их с количественной стороны.
В основе термодинамики лежит небольшое число закономерностей, установленных на основе большого числа опытных фактов и получивших название начала термодинамики.
У статистической физики и термодинамики общий предмет изучения – свойства вещества и происходящие в нем процессы. Подходя к изучению этих свойств с разных точек зрения, эти методы взаимно дополняют друг друга.
Совокупность тел, могущих обмениваться энергией между собой и с внешними телами, не входящими в эту систему, называется термодинамической системой. Одним из основных понятий термодинамики является понятие состояния системы. Состояние системы определяется совокупностью значений всех величин, характеризующих физические свойства системы и называемых термодинамическими параметрами (температура, давление плотность, теплоемкость, электропроводность и т. д.). Состояние системы называется стационарным, если значения всех термодинамических параметров не изменяются во времени. Стационарное состояние называется равновесным, если его неизменность не обусловлена протеканием каких-либо процессов во внешних по отношению к данной системе телах.
Исследования показывают, что параметры состояния тел взаимно связаны и могут быть выражены друг через друга. Поэтому термодинамическое состояние задается только ограниченным числом параметров состояния. Такие параметры называются основными параметрами состояния. Важнейшими параметрами состояния химически однородных систем являются плотность, объем, давление, температура. И между этими параметрами существует связь, выражаемая в виде математического уравнения 
Источник